關乎國內生技發展及癌症、重症患者權益的再生醫療雙法草案正在立法院進行審查,因行政院版針對醫療技術和藥品製劑採雙軌制有諸多標準不一,特別在針對醫療迫切需求病人,《再生醫療製劑條例》草案需進行二期臨床試驗,但《再生醫療法》草案第9條「免除臨床試驗」的除外狀況十分寬鬆,連日來學界、藥界質疑聲浪極大。
上週五(4月21日)立法院進行黨團協商,衛福部態度終於「轉彎」,將《再生醫療法》草案第9條局限在危及生命或嚴重失能之疾病,且國內沒有適當藥品才能申請,收縮適用對象。衛福部部長薛瑞元在會後向《報導者》記者直言,若不調整,未來「恐怕會變成很大的漏洞」,最後有7條法案未能通過協商,也讓《再生醫療法》能否在本會期闖關留下變數。
然而,儘管《再生醫療法》的立法是企圖將目前僅為行政命令的《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法》(簡稱《特管辦法》)提升法律位階,促進細胞療法等再生醫療技術與研究、也讓癌症等重症患者多一個選擇機會,但除了療效未明的爭議與疑慮外,病人接受醫療技術後若發生糾紛,權益保障性亦不明。《報導者》統計也發現,《特管辦法》上路後,包括台大醫院、台北榮民總醫院(簡稱榮總)兩大醫學中心龍頭態度都十分保守,迄今申請核可的案例僅有「1」件。
再生醫療雙法排入立院審查前夕,《報導者》推出〈失衡的再生醫療雙法草案:商機下被漠視的病人權益和醫療倫理〉報導,提出草案的五大爭議,台灣臨床藥學會等7團體與民間團體也罕見發出聲明質疑,近日各媒體也有諸多評論和報導,讓原本審查進展意外快速的《再生醫療法》草案,送入黨團協商後出現新變化。
- 治療危及生命或嚴重失能之疾病,且國內尚無適當之藥品或醫療器材。
- 經執行人體試驗結果,證實其安全性及初步療效。
- 提供不含基因改造或轉殖之人類細胞及其衍生物之細胞治療。
《再生醫療法》草案第9條,可免除臨床試驗、甚至醫院不必經過人體試驗倫理審查委員會(IRB)核准的除外條件,後門開得很大,包括危及生命或嚴重失能且無合適療法、人體試驗有初步安全及療效和不含基因改造或轉殖的人類細胞治療等3類狀況,都可以成為例外條件,免除人體試驗。
薛瑞元解釋,再生醫療的製劑規定是必須進行臨床試驗,但若遇到危及生命或嚴重失能的疾病,可採「附款許可」,即完成二期臨床試驗,並經審查風險效益、具安全性及初步療效者,可及早取得再生醫療新藥。而《再生醫療法》第9條,就如製劑的附款許可,作為緊急時的例外情形。但目前開放的3項情形範圍「太普遍」,因此決定限縮保留第一項「治療危及生命或嚴重失能之疾病,且國內尚無適當之藥品或醫療器材」,且明定申請時所需文件,包括要通過IRB核准。新版第9條條文如下:
醫療機構為治療危及生命或嚴重失能之疾病,且國內尚無適當之藥品,而執行再生技術,得檢附下列文件申請核准: 一、人體試驗倫理審查委員會核准之證明。 二、治療計畫書。 三、病人同意書。 四、細胞製備場所之證明。 前項各款得檢附相關資料之內容,由中央主管機關定之。
會後薛瑞元接受《報導者》採訪直言,提及法條「大轉彎」的原因,是與幾位立委溝通,加上蒐集媒體報導與專家學者的意見後決定。他坦言,原來的法條可能在幾次部會裡頭與專家討論,也做過幾次修正,最終反倒讓觀念有些模糊,這次決定拿掉原先規定的第二款、第三款,以免引起爭議,「不然以後恐怕會變成很大的漏洞。」
不過,當日立委們並未接受衛福部新修正動議,決定予以保留,擇日再討論。薛瑞元說,今天是第一次提出新法條,也讓委員們回去「消化」一下。最終《再生醫療法》草案共有7條保留,留待下次協商討論。

過去新藥或新治療正式取得藥證核可前,就是臨床試驗階段,因為療效未實證,所以病人若接受臨床試驗,醫院和藥廠不得向其收費;但如罕病或重大疾病,病人數少,無法有足夠病人數完成正規臨床試驗,或國內巿場太小沒有藥廠進口,2016年衛福部鬆綁《人體試驗管理辦法》讓這類生命與時間賽跑的重病患者,在沒有其他替代療法的前提下,可以自費使用仍在臨床試驗階段的療法或藥物,但前提仍是已進入二期臨床試驗,有初步療效及安全性的藥物和治療,且仍需經醫院倫理委員會審查,即被稱為「恩慈療法」。
- 自體CD34+ selection周邊血幹細胞治療(腦中風、下肢缺血症)
- 自體免疫細胞治療(癌症)
- 自體脂肪幹細胞(慢性傷口)
- 自體纖維母細胞(皮膚缺陷修補)
- 自體骨髓間質幹細胞(退化性關節炎、骨髓損傷)
- 自體軟骨細胞(膝關節軟骨缺損)
事實上,《特管辦法》開放上路以來,迄今國內、外在使用最廣泛的癌症免疫細胞療法這一塊,仍缺乏大規模的療效實證支持,在醫界也形成了兩極化態度。
據衛福部統計,截至2022年12月31日,衛福部醫事司共核准208件申請計畫、有954名病人接受治療。其中,自體癌症細胞治療,共核准140件、已有778人接受治療,超過8成。
石崇良表示,現行《特管辦法》下,醫院遞交申請書,需以文獻、國外臨床試驗資料為佐證,但不需要國內自行申請臨床試驗、也不需通過院內人體倫理試驗委員會。計畫書通過審核後,符合的病患與醫師討論後就可接受治療。
但當初被喻為「《特管辦法》的開放就像一個火車頭」,可帶動創造新經濟體的機會,讓細胞療法有望晉升為媲美半導體產業的經濟體,如今只看見嚴重的地下化問題、甚至成為新興詐騙手法。最尷尬的是,臨床醫學的兩大龍頭台大、榮總,幾乎完全不往這一塊積極發展。
(延伸閱讀:〈「檯面上700例、實際執行超過7萬例」──揭開細胞治療地下化生態〉)
「《特管辦法》核准了200多件病人自費的細胞治療申請案,為什麼台大醫院至今不願意做?」曾任行政院衛生署藥政處處長、衛生署副署長的蕭美玲,觀察近期再生醫療討論時,提到心中最大的疑問之一。
積極推動《再生醫療法》的立委之一、民進黨不分區立委邱泰源,以及任職衛福部醫事司司長期間主導規劃政院版法案的現任健保署署長石崇良,都是台大醫師出身。然而,《特管辦法》上路5年,台大申請核准的案例一直掛「0」,直到近兩週才終於有第一項申請核准案,對於要病人自費做這項高價但屬於「試驗性」階段的治療,明顯並不支持。
台大醫院臨床試驗中心前主任陳建煒日前在《報導者》投書中更提及,當時衛福部高層曾向台大高層「關心」為何不加入。
(延伸閱讀:〈陳建煒/愛之適足以害之,《再生醫療法》放寬未必能促進產業發展〉)
《報導者》整理台灣目前35間醫院、一共87個《特管辦法》的癌症細胞治療計畫,因為沒有專一性,不少計畫一次就能收10種癌症的病人;例如其中有73個計畫都可治療大腸癌、68個計畫涵蓋肺癌、59個計畫可用來治療肝癌等。
除了對療效存有疑慮外,對於這類沒有正式藥證的治療,一旦發生問題和糾紛,既不適用藥害救濟、又毫無處理機制,讓醫、病都承擔風險且未有足夠保障,這都是台大、榮總等院卻步的主要原因。
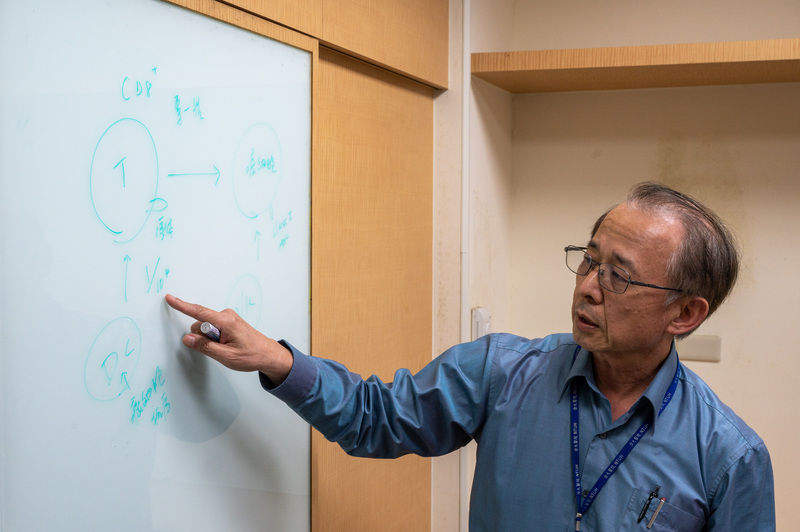
擔任台大醫院副院長期間,積極推動台大細胞治療中心的台大免疫學研究所教授江伯倫提到,台大當然還是希望走正統的臨床試驗途徑,原本他打算申請自然殺手(Natural Killer, NK)細胞臨床試驗,做一個比較完整的實驗,再去比較看看效果。
結果不久,《特管辦法》通過,原先的計畫因而停擺,細胞治療在台大反而變得進退兩難。因為《特管辦法》申請不需要國內本土的臨床試驗,也不用通過IRB,可檢附國外的初步試驗結果,這更難有明確的療效數字。
「我們提供這項治療本來就是為了病人,但如果不太確定療效好到什麼程度,還要不要做?」江伯倫說。他也認為,當時《特管辦法》「好像走得太快了」。
此外,《特管辦法》的模式是由醫院尋找配合培養細胞的生技公司,當醫院收案病人、抽血後,檢體就會拿到生技公司進行培養,完成後再送回醫院,回輸到病人身上。這代表細胞的好壞品質,都決定在生技公司身上。
現有規範下,醫院只負責執行、將細胞打回病人身上,但細胞的製備、品質檢驗,都來自於生技公司。但若病人接受治療後效果不好、出現嚴重副作用,可想見會由醫院來承擔。江伯倫說,台大醫院內部討論時也提到,若台大要委託廠商製作細胞,為了維護品質,醫師必須將收到的細胞成品再次檢驗過,才能打到病人身上,否則生技公司的產品出問題,最終仍得由醫院來承擔。
江伯倫說,台大沒有資金自己籌備細胞製備實驗室,但又不敢貿然與生技公司合作。當時討論到,若真要跟外部生技公司合作,江伯倫打算多編列一些助理,把拿回來的細胞,自己再測試一下內容物,若覺得沒問題再打回病人身上。但他也指出:
「最大的問題還是萬一治療沒有效、中間過程出問題,病人不會追究廠商,但會質疑台大。考量到這些,台大相對就變得比較保守。」
陳建煒也觀察,台大醫院醫師對於申請制,而非走正規臨床試驗的《特管辦法》興趣缺缺。《特管辦法》沒有大型臨床試驗、治療效果數據,成為醫院保守的原因之一。擔任衛生署技監和參事期間,參與推動藥品查驗中心(CDE) 設立的蕭美玲不解,為了建立以「實證基礎為導向」、符合科學性的醫療科技評估制度,與國際體系和標準接軌,「這條路努力了2、30年才建立起來,現在要跳脫實證醫學的路徑,為什麼?」
蕭美玲直言,再生醫療技術的做法就像「付費的臨床試驗」,如果衛福部認定這是成熟技術,那就應該讓醫院積極執行,甚至考慮納入健保給付才合理。
但事實上,目前已取得藥證的昂貴新藥、新技術,納入健保後,健保署與藥廠簽訂還有「無效退費協議」。以標靶藥物來說,2018年衛福部為了加速新藥納入健保的速度,在《全民健康保險藥物給付項目及支付標準》中,新增「藥品給付協議」(Managed Entry Agreement, MEA),以療效或財務結果與藥廠協議給付狀況,如評估病人的整體存活狀況、臨床療效等結果,效果不佳,廠商需要還款一定比例的藥費、或提供固定折扣、補助治療或搭配其他藥品的部分藥費等等。
2017年C型肝炎口服新藥納入給付,當年度就有212名病患列入無效退費名單,但藥廠退回的費用再回流到原本的C肝專款總額中,等於當年再增加了212名公費治療名額。但目前自費做細胞療法的病人,全額自費,不僅無退費、甚至根本無從獲悉「有沒有效」。

至今細胞治療執行個案最多、最積極的是中國醫藥大學附設醫院,共有13個計畫,包含中國醫總院7件、中國醫北港附設醫院1件、中國醫新竹附設醫院5件,項目包含樹突細胞(Dendritic Cell, DC)、細胞激素活化殺手細胞(Cytokine-induced Killer Cell, CIK)、DC-CIK合併療法與Gamma-Delta T治療,也協助其他醫院培養細胞,例如秀傳紀念醫院、國泰綜合醫院、博田國際醫院、奇美醫院等共10件申請案;而由中國醫大協助興建經營的台南市立安南醫院,也申請通過了5件癌症細胞治療案。
中國醫藥大學新竹附設醫院放射腫瘤科主任郭于誠指出,該院在《特管辦法》還沒開放前,就已經在研究癌症細胞治療DC-CIK的人體臨床試驗,累積了不少經驗。醫院認為台灣有很多醫療科技實力,鼓勵醫師積極參與各項醫療研發、造福更多病人,因此中國附醫將細胞治療、3D列印及AI人工智慧等新科技都視為有潛力的發展項目,「醫院是在這樣的起心動念下開始進行細胞治療。」
但郭于誠坦言,臨床醫師們對於細胞治療是作為合併治療使用,或是傳統的癌症治療已經無效了再進行,也都沒有共識,「我的立場是要慎選病人,要有成功的把握跟機會,這樣才對得起付錢的人。」
江伯倫的考量,也帶出關鍵問題:一旦治療上有疑慮,病人的權益如何保障?如果民眾要申請救濟補償,又該怎麼辦?
蕭美玲解釋,一般情況下,藥品在完成三期臨床試驗,確認安全性和有效性後,食藥署核可就能取得許可證上市。由於前三期臨床最多做了幾萬人的試驗,但上市後是給幾百萬、幾千萬人使用,不免也可能出現非預期的副作用。因此臨床試驗第四期是「上市後監測」,觀察藥品上市後的使用情況。
沒有一種藥物百分百安全,如果不幸出現嚴重副作用,民眾可以依據2000年通過的《藥害救濟法》申請救濟補償。但是目前《特管辦法》、未來《再生醫療法》規管的醫療技術,無法適用藥害救濟。
蕭美玲強調,「藥害救濟的前提是,藥品必須要拿到食藥署核可的許可證。」但目前《特管辦法》或未來《再生醫療法》規管的治療行為,如果根本不需要進行臨床試驗,更別提要拿到正式藥證。
現行《藥害救濟法》第7條的規定下,救濟金是政府向藥廠徵收的基金,金額用前一年藥廠的銷售額來計算。當基金總額在新台幣3億元以下,徵收0.1%;3億元以上,則視情況徵收0.02%到0.2%。但如果再生醫療技術未經臨床試驗、不會有藥證,自然不會提撥藥害救濟基金,病人即便可能有不良反應,也無可申訴和救濟。
石崇良雖強調,未來《再生醫療法》的救濟部分將會與現有的藥害救濟管道不同,但實際上救濟如何認定、處理,已授權給子法訂定,因此目前還不確定細節。他也表示,目前《特管辦法》下的細胞治療,執行上沒有傳出任何嚴重副作用的個案或糾紛。
但多數使用免疫細胞療法的癌症病人,其實都合併使用其他正式核可的標靶或化療藥物,合併用藥之下,病人若有狀況,很難分辨是因為哪個藥物造成的問題。有醫藥人士便透露,已有其他癌症用藥的藥廠不滿,認為如果無限擴張病人使用沒有藥證的細胞療法,那些出狀況的個案可能被錯誤算在正規抗癌藥物的身上,甚至可能會排擠到目前的藥害基金。

政治大學法學院生醫倫理與醫事法律研究中心主任劉宏恩表示,責任保險的設計並不是用來保護病人。保險公司理賠的前提是被保險人,即醫院有賠償責任,但這必須由病人來證明,且要同時舉證兩件事情:
- 病人的損害跟細胞治療有因果關係
- 醫院在執行細胞治療時有過失
劉宏恩直言:「這根本不可能舉證成功。」
若與《藥害救濟法》相比較,劉宏恩說是天地之別。《藥害救濟法》不需要病人自行舉證,主管機關可自行調閱醫療機構的病歷、用藥紀錄等各項資料;審議是由醫界、藥界、法律界專業人士組成「藥害救濟審議委員會」,只要有因果關係就補償,不需要證實藥廠有過失行為。
此外,《藥害救濟法》第16條規定,審議委員會必須在3個月內(疫苗6個月內)完成審議結果。「但未來民眾接受細胞療法,要向誰舉證?只有法院。比起藥害救濟的3個月,法院依照程序可能要等上3年,」劉宏恩表示,再生醫療技術的風險與不確定性較高,而且病人是高額自費,但是能夠享有的救濟保障卻是如此微小不易,這在法律制度設計上明顯有失平衡。他感嘆:
「民眾能尋求的責任保險就像海市蜃樓、像幻影,看得到吃不到,最可憐的還是病人。」
療效之外,病人在接受治療前,可以知道哪些數據、如何判斷自己適合接受治療?生技公司告訴我們,可以和醫院索取細胞的出廠檢驗報告書(Certificate of Analysis, COA);江伯倫也提到,生技公司在培養細胞時,可先測試細胞在體外殺癌細胞的效果,應讓要把這個測試結果提供給病人,在日本做細胞治療的機構,這部分載明的很詳細。
石崇良則建議,哪家醫院與哪家生技公司、或使用哪種細胞,其實不是病人優先考量的項目,「病人應該先與信任的癌症治療醫師商量,了解自己適合哪類的治療,若該醫院無合適的治療,再決定是否轉院治療。」
台灣開始注意再生醫療的臨床應用,是2015年的八仙樂園彩色派對火災(又稱八仙塵爆),造成15死、484傷,其中燒燙傷面積80%以上的人有41人,燒燙傷面積40%~80%者有240人。當時部分傷患接受國際援助,由日本富士軟片(Fujifilm)旗下再生醫療及組織工程公司J-TEC提供「自體培養表皮」,先取得患者身上2x3公分大小的皮膚,送回日本愛知縣的實驗室培養,3週後將培養到的8x10大小皮膚移植回患者身上,讓國內醫界眼睛一亮,也讓衛福部決定加速推動再生醫療法案的立法。
近十年,細胞治療是全球生醫研究的火熱領域,諾貝爾生醫獎連續頒給細胞研究領域:2012年頒給研究「誘導性多能幹細胞」(iPS)的山中伸彌;2018年,又頒給美國詹姆斯・艾利森(James Allison)與日本本庶佑,兩人找出免疫抑制分子「CTLA-4」和「PD-1」,研發出抗癌藥物,大大推進癌症免疫療法。
臨床使用上最大的突破,則是2017年諾華藥廠通過美國食品藥物管理局(FDA)核准的「嵌合抗原受體T細胞療法」(Chimeric Antigen Receptor T-cell Therapy, CAR-T)治療復發型/難治型B細胞急性淋巴性白血病、難治型瀰漫大B細胞淋巴瘤,以及難治型濾泡淋巴瘤,效果驚人。在美國臨床試驗平台以「Cell Therapy」搜尋,目前就有超過44,000件計畫。全球也掀起「養細胞」工廠風潮,細胞治療確實是生技藍海。
但是,這與台灣最盛行的免疫細胞療法方向不盡相同。《特管辦法》開放後,700多件都是用在國際已認為效果不顯著的癌症免疫細胞療法,不過,業界和研究單位真正有信心發展成產品、走入「新藥開發」的臨床試驗申請案,目前共有120件,其中87件為細胞治療、33件基因治療,而87件為細胞治療中55件是幹細胞,包含間葉幹細胞、脂肪幹細胞、周邊血液幹細胞及嗅鞘幹細胞等,僅24件為癌症治療領域相關試驗。
曾跨足生技產業、免疫學專長的長庚大學臨床醫學研究所教授顧正崙指出,以癌症為例,過去不管是化學藥物、單株抗體,人類幾乎都已經研究透徹,但細胞治療是一個全新的方法學,他比喻,「如果傳統治療是螺絲起子,細胞療法就像自動化機器人,」而後者的潛力還沒完全被開發。
顧正崙舉例,目前效果最顯著的CAR-T,就像一把精細的剪刀放在體內,由細胞來殺體內的癌細胞,且目前證實對於血液癌症有可以治癒的強大能力:
「科學家就會想,那我們是不是可以幫所有癌症都設計一把剪刀?而且不一定要是量身訂做,而是任何人都可以用?所以全球百萬科學家都投入研究,會不會成功不知道,但大家都願意試試看。」若有了突破的一天,影響的病人數將難以估計,癌症也將消失,「這是我們第一次覺得有能力改變人類的歷史。」
根據研究機構(Research Nester)估計,細胞治療的市場將在2029年達成1,000億美元(約新台幣3兆元)的規模,腫瘤癌症則估計可達740億美元(約新台幣2.3兆元),遠超過其他心血管疾病、皮膚疾病、困難傷口等。而根據另一家倫敦市場調查數據公司TechNavio分析,因為CAR-T的有效性,讓2018年至2022年CAR-T的市場成長顯著,年增長率162%,增值成長近8億6,000萬美元(約新台幣265億元)。
此外,再生醫療幹細胞領域,雖然不像癌症CAR-T已有顯著的成果,但在山中伸彌發現iPSC可以分化成各式各樣的細胞而獲得諾貝爾獎後,也點燃了科學家們的希望,投入大量研究,希望了解這些細胞未來是否可以繼續發展,並且應用在各種疾病上。
顧正崙說,隨著細胞療法的成功,各國都在投入,台灣也不能在這場軍備競賽中缺席。但鼓勵研發與病人權益,必須取得平衡。美國FDA對於細胞療法相對應的法規採取愈來愈嚴格的方式,目的是要以病人的利益為優先考量,但藥廠要投入的金額就會愈來愈高,投入門檻高也可能影響研發的速度。而台灣市場小、藥廠規模普遍小,經濟部可以思考要走自己的路,或跟進美國的嚴格法規來推動產業,「但衛福部主導的醫療法規,是為了保護病人、保障病人權益而存在的。」
顧正崙認為,法規必須要有全面周延的規範,推動產業往真正有潛力的正規研究發展,也讓認真、守規矩的人願意投入,否則不但傷害病人權益,也會對生技產業造成不良影響,最終形成劣幣驅逐良幣的情況。
用行動支持報導者
獨立的精神,是自由思想的條件。獨立的媒體,才能守護公共領域,讓自由的討論和真相浮現。
在艱困的媒體環境,《報導者》堅持以非營利組織的模式投入公共領域的調查與深度報導。我們透過讀者的贊助支持來營運,不仰賴商業廣告置入,在獨立自主的前提下,穿梭在各項重要公共議題中。
你的支持能幫助《報導者》持續追蹤國內外新聞事件的真相,邀請你加入 3 種支持方案,和我們一起推動這場媒體小革命。