衛福部食藥署(TFDA)日前公告「國產COVID-19疫苗緊急使用授權(EUA)審查標準」,要以免疫橋接方式,讓國產疫苗與英國牛津AZ疫苗,在中研院實驗室進行血清中和抗體值的「PK」,採取國際開始討論、但迄今尚未有結論的抗體保護力濃度(Correlate of Protection, CoP)做為保護力指標,引發各界爭論。如此研製的國產疫苗要與國際接軌,更有諸多考驗。
以這次中研院要替國產疫苗進行「血清中和抗體」的檢測為例,我們鄰近的新加坡就已開發出商品化的檢測方式,在這次疫情中受到國際關注、並於創新全球實驗室檢測上拔得頭籌──美東時間2020年11月6日,美國FDA宣布核准了第一個用來偵測感染過SARS-CoV-2血清中和抗體的檢測試劑:cPass™。
故事要從病毒感染宿主細胞說起。宿主細胞在被病毒感染後,會讓宿主的免疫系統活化,並使個體產生免疫反應,製造出抗體。有些抗體會和病毒結合,但不一定能阻止病毒感染,這一類的抗體稱為「結合抗體」 (Binding Antibody),因為抗原抗體結合位置的差異,結合抗體只能發送出細胞已經被感染了的警示,不會影響病毒對宿主細胞的感染力。
真正具有阻止病毒感染細胞能力的是「血清中和抗體」(Neutralizing Antibody, NAbs)。它是在宿主被病毒感染後,體內所產生能夠有效減低細胞感染的抗體,透過辨認病毒與宿主細胞結合的特定抗原,有效抑制病毒進一步感染宿主細胞。這個抗體的存在,代表經過自然感染或接種疫苗後,體內B細胞所產生可以有效清除病毒的抗體。因此,血清中和抗體可以用來檢測疫苗的效果,也可以用來測試族群中受病毒感染者的比例,並且協助衛生主管機關去追蹤和回溯感染者病毒的感染情形。
美國FDA給予新加坡cPass™試劑緊急授權(Emergency Use Authorization, EUA)有一個重大意義:意味著世界各大實驗室偵測感染SARS-CoV-2病毒之後血清中和抗體的方式,因此發生實質性的改變。
這個緊急授權的背後,也是新加坡作為一個還沒有COVID-19疫苗自製能力的小國,展現科研實力勘比大國的跨量級參賽世界盃的代表作。
傳統上檢驗血清中和抗體的黃金標準為病毒中和試驗(Virus Neutralization Assay),這種方式為病毒斑塊中和測試(Plaque Reduction Neutralization Test, PRNT)。過程需要將活病毒與不同連續稀釋倍數的血清混合,再加入細胞一起培養,藉此判斷是否能抑制病毒斑塊的形成。爾後跟沒有混和血清的病毒斑塊數量作比較所得到的值,稱作PRNT50,代表抑制50%病毒斑塊數目形成所需要的血清濃度。如果這樣的測試方式是在微量滴定盤(Microtiter plate)上操作,也稱為微量中和試驗(Microneutralization)。
這樣的病毒中和試驗,過往需要由高度專業的操作者要在生物安全第三等級(BSL3)的實驗室內進行,且要耗費數日才能得到結果。也因此,如果能發展一套在一般BSL2等級的實驗室內(即P2等級實驗室)就能夠進行的測試,在對於偵測血清中和抗體的時效及操作人員的生物安全防護上就能帶來新的突破。
cPass™這個技術是利用模擬病毒宿主細胞的交互作用來快速檢測中和抗體的方式。SARS-CoV-2病毒感染宿主細胞時,病毒蛋白上的受體結合區域(receptor-binding domain, RBD)必須要先和宿主細胞膜上的受體ACE2結合。若血清中產生出中和抗體則可以和病毒的RBD結合,以阻斷病毒RBD和宿主ACE2的結合。
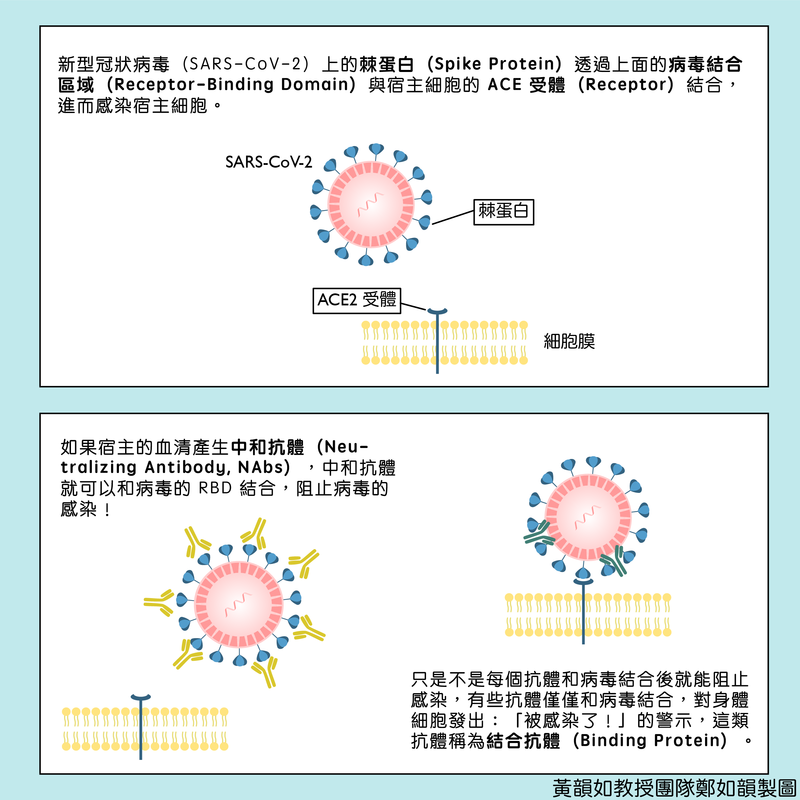
以技術端來說,這並不是一個多麼新創的試驗,所用的技術平台是非常常見的競爭酵素連結免疫吸附法(Blocking ELISA Detection Assay)。測試的方式是利用血清先與定量帶有辣根過氧化物酶(horseradish peroxidase,HRP)的 RBD (HRP-RBD)混和,如果血清中有足夠的中和抗體,那麼這些中和抗體就會跟HRP-RBD結合,這些被血清中和抗體所佔滿的HRP-RBD就無法再跟原本的受體ACE2結合。
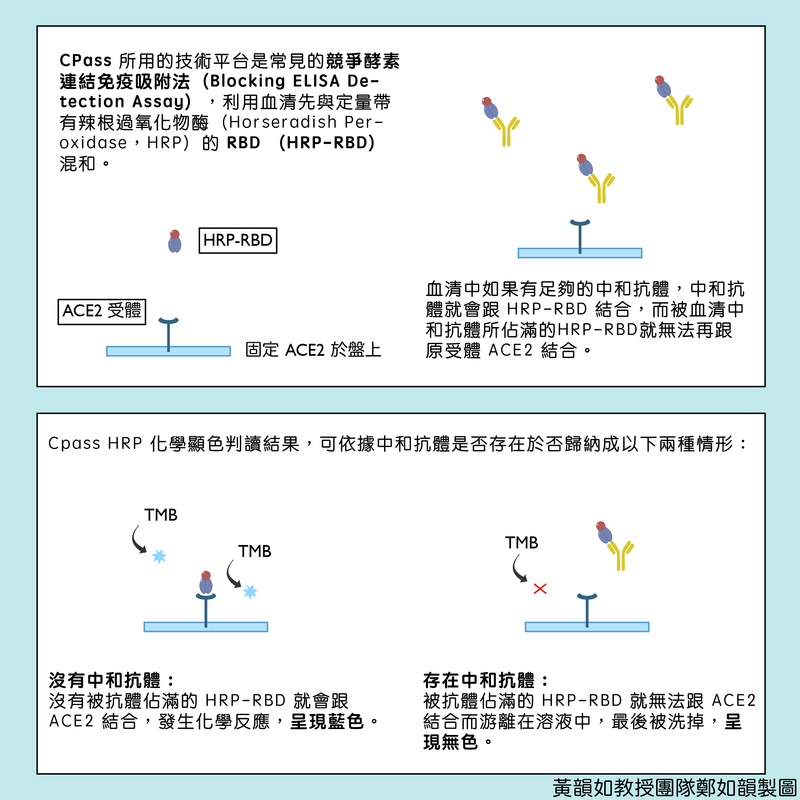
而最後偵測的方式,則是利用HRP化學顯色的反應來判讀。血清與HRP-RBD的混和物會被加到已經放有固定定量的ACE2微量盤上,如果沒有中和抗體,沒有被抗體佔滿的HRP-RBD就會跟ACE2結合,呈現藍色。反之,如果中和抗體存在,那麼被抗體佔滿的HRP-RBD就無法跟ACE2結合,則會游離在溶液中,最後被洗掉,而不會出現藍色的反應。
cPass™ 中和抗體的檢測方式只要在數小時內就可以得到檢測結果,操作上沒有太多複雜的技術,在大多實驗室也能操作,除此之外還有高通量和全自動的優勢,且具有高度的敏感性和特異性,也不受到物種的限制,因此除了可以在人類上做應用,往後在任何的物種上也有都機會使用到這項技術。
如果故事只看到這裡,那麼很可能會認為這是一個沒什麼了不起的技術,不過是剛好在一個世紀大疫COVID-19爆發的時候,一家美國生技公司順應潮流的商業行為。
但cPass™的背後,卻是新加坡近年來持續投資在產官學技轉平台的成功故事。
cPass™技術是由杜克新加坡大學新興傳染病研究計畫(Duke-NUS emerging infectious diseases programme)的王林發(Wang Linfa)教授,與美國 GenScript 生物科技公司(GenScript Biotech Corporation)、新加坡的科技研究局(Agency for Science, Technology and Research,簡寫為A*Star)的診斷發展中心(Dignostics Development Hub, DxD Hub)共同合作開發。
王林發教授出身上海,完成大學教育之後,在美國加利福尼亞大學戴維斯分校(UC Davis)獲得博士學位,早期的研究從澳洲起步,最為人所知的發現是發現蝙蝠為SARS病毒的自然宿主,長期投入以蝙蝠為宿主的病毒學研究。
A*Star下的診斷發展中心DxD Hub平台,於2014年11月正式成立,由新加坡國家研究基金會(National Research Foundation, NRF)資助,肩負為新加坡發展完整又有效能的診斷技術開發生態系統,透過授權本地新創企業、中小企業,以及國際企業,將科學研究結果加速技術轉譯至臨床上能使用的的診斷技術,最終商品化成為市場上的產品。
DxD Hub以四大流程:優化(Opmisation)、確效(Verification)、驗證(Validation)、生產(Production),開發高效能的診斷產品,促進新加坡本地的研究和應用成果不僅可以供給當地,也能走向國際。
在新加坡學研單位與COVID-19的戰役中,產官學的合作其實不是新鮮事,cPass™並不是第一個在檢測上展露頭角的產品。其他透過研發技術轉譯而來的 COVID-19核酸檢測套組Fortitude和Resolute,都是在新加坡當地研發並走向國際的產品。
新加坡的PCR檢驗量能,從疫情一開始的單日2,900例到移工宿舍疫情爆發時單日 40,000例的大幅成長,Fortitude Kit有很大的功勞。2020年的2月,當時 SARS-CoV-2的序列發表一個月後,陳篤生醫院、DxD Hub與新加坡當地新創公司MiRXES就共同開發了這個利用RT-PCR來精準檢測SARS-CoV-2病毒的套組,這也是新加坡衛生科學局(Health Science Authority, HSA)第一個核可的臨床診斷COVID-19的篩檢套組。
在由原本的Fortitude Kit為基礎,開發出鑑別A及B型流感病毒和COVID-19的2.0版第二代套組,讓這個臨床快篩試劑,可以在醫療現場做更廣泛的應用。在2020年5月,美國的西達賽奈醫療中心(Cedars-Sinai Medical Center)使用 Fortitude Kit 2.0取得內部實驗室檢測的 FDA EUA;2021年1月,這個 Fortitude Kit 2.0也已經得到歐盟的CE合格認證。
從前面的兩個例子,我們不難發現,新加坡有著一套產官學研發協作的清晰路徑,這條路徑並不是因為COVID-19疫情而一夜之間憑空出現,乃是持續投資的積累成果。而這一條產官學研發協作的最終路徑,絕對不是只著眼於新加坡本地600萬人口的小型市場,目標一定是放眼國際的商業操作模式。而為了打入國際市場,通過主要國際監管認證核可便是無可避免要面對的國際標準。
DxD Hub帶領新加坡產學界打世界盃的成功因素之一,其實免不了又得歸因於新加坡已然成為國際生技製藥產業亞太區域總部的落腳之處 ,除了前十大國際藥廠幾乎都把亞太總部設於新加坡之外,幾大國際生技或儀器廠商例如Thermo Fisher Scientific、Becton Dickinson(BD)、Medtronic等,都在新加坡設有研發或是區域總部。在這樣的生態圈中,當面臨到COVID-19這個席捲全球的世紀大疫,如果DxD Hub沒有趁勢帶著學研界一起與產業界協作開發產品,那才是一件奇怪的事。
如果故事只看到這裡,或許會認為不過是研發幾種檢測試劑,然後就算拿到國際FDA、CE等等認證,那又如何?這樣成功的產官學生技研發活動,台灣也不是沒有啊!
我們必須再把整個生態圈放大來看,看看這些檢測試劑在COVID-19預防、診斷、治療的完整解方(total solution)的價值鏈(value chain)中的角色。
以COVID-19的疫苗生產製造來說,雖然新加坡目前並沒有自製的產線,但德國的BioNTech即將把亞太總部設在新加坡,並且拉出一條完整的mRNA疫苗生產產線,目標是供應亞太區域所需的疫苗。
倘若現在台灣念茲在茲的「免疫橋接」國際潮流會在不久後的將來實現,新加坡所開發出的血清中和抗體檢測試劑,或者任何次代的產品,在打進BioNTech新一代疫苗的測試端供應鏈中,將會有地利之便。這種先來後到的卡位戰,對長年發展科技代工產業的台灣應當不陌生。
目前世界上的研發潮流,在檢測端以及藥品端已經是採取平行發展的模式,意思是在藥品研發從前臨床期進入臨床試驗過程的同時,任何伴隨性的檢測方法也都會跟隨著相同進展的腳步,同步開發。
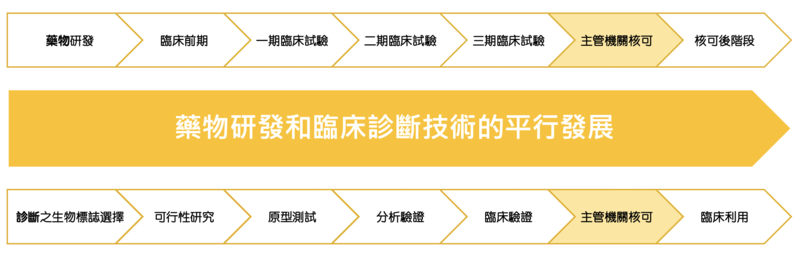
新加坡未來可能將會擁有不但具國際標準、並且有強大競爭力的疫苗完整解方的價值鏈。而mRNA的疫苗技術,除了應用在預防病毒的感染,還有應用在癌症治療發展的巨大潛力。因此這樣的投資,也絕不是只短視於眼前的COVID-19疫情,而是國家資本對於生技醫藥前沿科技發展有前瞻眼光的中長期布局。
反觀台灣,我們目前的國產疫苗研發,卡在一個「符合國際潮流的台灣標準」。這樣不按照國際標準來做會帶來的問題,第一是不但不知道未來的潛在國際市場會在何處?第二是我們若有同步研發出來的血清中和抗體檢測試劑,要如何有同步進展也會是一個問題。因為,國際上對於檢測的監管規範,不會有任何鬆綁的跡象。
目前負責台灣國產疫苗臨床試驗的免疫橋接研究,血清中和抗體分析是由中研院來進行。對於這個血清中和抗體檢測,台灣能不能也從平行開發商轉的規劃角度來看?或者,台灣若已經有血清中和抗體的檢測產品,能不能利用國產疫苗開發的機會,也來進行對於疫苗接種後的驗證?若這個免疫橋接測試的最終目的,只是為了讓「台灣標準」的國產疫苗,找到「符合國際潮流」的台階,這就失去了台灣能夠提供完整解方的價值鏈機會。
目前台灣的生技製藥生態圈中,缺乏國際大廠作為領頭羊,若繼續閉門造車,台灣要前進「世界盃」只會更加遙不可及。台灣在代工生產國際大廠疫苗的布局,也還未看見一條清晰的路徑。台灣的晶圓代工產業經驗已經告訴我們,對於國際關鍵價值供應鏈有「鎖喉戰略」地位的規模與水準,才能顧全國本。當晶圓代工業者開始被要求分散製造風險而向外擴廠的時候,台灣還有什麼其他產業能夠確保我們的戰略地位呢?我們有沒有認真地誠實檢視?若要為世界提供COVID-19的完整解方,台灣的產官學界在國際價值鏈上的戰略定位為何?COVID-19過後,我們會是那可被忽略的小島嗎?
新加坡改變中和抗體檢測方式的cPass™,透露出的不只是一個看似簡單的酵素連結免疫反應,背後是一個以人口數來說可被忽略的小國,善用與國際接軌的產官學研發協作路徑,展現他們可以提供國際社會在生技醫藥完整解方的雄心大志。
同為島國的台灣,面對檯面上艱難的國際地位,更需要靠著檯面下的民間實力打進世界盃。任何產業的「世界盃」競技,其實都少不了有國族主義的角力,但也都有放諸國際皆準的規則。台灣國產疫苗或生技業要打國際賽,需要有更全面的政策與環境布建,並符合國際發展與規則,才能真的進入「賽局」競逐圈之內。
用行動支持報導者
獨立的精神,是自由思想的條件。獨立的媒體,才能守護公共領域,讓自由的討論和真相浮現。
在艱困的媒體環境,《報導者》堅持以非營利組織的模式投入公共領域的調查與深度報導。我們透過讀者的贊助支持來營運,不仰賴商業廣告置入,在獨立自主的前提下,穿梭在各項重要公共議題中。
你的支持能幫助《報導者》持續追蹤國內外新聞事件的真相,邀請你加入 3 種支持方案,和我們一起推動這場媒體小革命。